Nos avions ?
http://fr.wikipedia.org/wiki/Stator%C3%A9acteur
http://fr.wikipedia.org/wiki/Turbor%C3%A9acteur
Le turboréacteur est un système de propulsion essentiellement utilisé pour les avions. La poussée résulte de l'accélération de l'air entre l'entrée (manche à air) et la sortie (tuyère). Elle est obtenue par la combustion d'un carburant, généralement du kérosène, dans l'oxygène de l'air. Une partie de l'énergie produite est récupérée par une turbine et sert à comprimer, à l'entrée du réacteur, l'air, utilisé comme comburant.
Pollution atmosphérique
Les émissions polluantes issues de la combustion du kérosène sont l'un des problèmes majeurs du turboréacteur pris « à bras le corps »[13] par les ingénieurs. Néanmoins, ils doivent être relativisés, puisque le trafic aérien ne représente que 5 % des émissions polluantes au voisinage des habitations, et que le CO2 émis ne contribue à l'effet de serre du globe terrestre qu'à hauteur de 2 %. Les effets des traînée de condensation sont « sensibles, mais à préciser »[13].
Toutefois, la pollution aérienne en haute altitude pourrait avoir bien plus d'impact sur l'environnement et notamment sur l'amincissement de la couche d'ozone. En effet, 75 % des émissions des turboréacteurs ont lieu en vol de croisière dans la troposphère et la basse stratosphère[21].
Le kérosène est un mélange d'hydrocarbures contenant des alcanes (CnH2n+2) de formule chimique allant de C10H22 à C14H30. Issu du raffinage du pétrole, il résulte du soutirage pendant la distillation d'une coupe avec un point initial (PI) de distillation compris entre 150 °C et 180 °C, et un point final (PF) de distillation entre 225 °C et 250 °C. Il doit être exempt de soufre.
Il est utilisé essentiellement dans la fabrication de carburant pour l'aviation (turboréacteurs et turbopropulseurs), notamment du Jet A1, le principal d'entre eux. C'est le composant principal des additifs pour automobiles (nettoyage injecteurs, etc.)[réf. souhaitée]
Utilisation comme carburant pour l'aviation
Son usage en aviation est principalement dû à son fort pouvoir calorifique de 43,15 MJ·kg-1 pour le Jet A1, qui autorise une plus grande autonomie à masse embarquée égale, ou, en d'autres termes, qui permet d'alléger la masse totale à emporter à autonomie constante. Comme carburant pour l'aviation, le kérosène doit remplir des conditions particulières, notamment au niveau de ses propriétés physiques. Le carburant pour avion est ainsi un kérosène particulier ayant notamment un point de congélation très bas (-47 °C pour le Jet A1 [7]), car à 11 000 mètres d'altitude, la température externe est proche de -65 °C.
Un hydrocarbure (HC) est un composé organique contenant exclusivement des atomes de carbone (C) et d'hydrogène (H). Ils possèdent en conséquence une formule brute de type : CnHm, où n et m sont deux entiers naturels.
Sous forme de carbone fossile, ils sont une ressource énergétique essentielle pour l'économie depuis la révolution industrielle, mais aussi source de gaz à effet de serre issus de leur utilisation massive.
Ce sont alors des ressources non renouvelables (à échelle humaine de temps), dont les gisements commencent localement à s'épuiser ou à être très coûteusement et plus difficilement exploitable (gisements offshore ou très profonds, et souvent de moindre qualité), qu'il s'agisse du charbon[1], du pétrole [2] ou du gaz naturel [3].
L'hydrogène est un élément chimique de symbole H et de numéro atomique 1.
L'hydrogène est le principal constituant du Soleil et de la plupart des étoiles, dont l'énergie provient de réactions de fusion thermonucléaire de l'hydrogène
La fusion nucléaire, dite parfois fusion thermonucléaire, est un processus où deux noyaux atomiques s’assemblent pour former un noyau plus lourd. Cette réaction est à l’œuvre de manière naturelle dans le Soleil et la plupart des étoiles de l'univers.
La fusion de noyaux légers dégage d’énormes quantités d’énergie provenant de l’attraction entre les nucléons due à l’interaction forte (voir Énergie de liaison atomique). Elle est, avec la fission, l’un des deux principaux types de réactions nucléaires appliquées. Un de ses intérêts est de pouvoir produire théoriquement beaucoup plus d’énergie (de 3 à 4 fois plus), à masse de « combustible » égale, que la fission. De plus, les océans contiennent naturellement suffisamment de deutérium, 16 grammes par m3, pour permettre d’alimenter en énergie la planète pendant quelques centaines de millénaires[réf. nécessaire]. En dépit des travaux de recherche réalisés dans le monde entier depuis les années 1950, aucune application industrielle de la fusion à la production d’énergie n’a encore abouti, en dehors du domaine militaire avec la bombe H, étant donné que cette application ne vise aucunement à contenir et maîtriser la réaction produite. Il en existe cependant quelques autres usages moins médiatisés, comme les générateurs de neutrons[1].
Contrairement à la fission nucléaire, les produits de la fusion eux-mêmes (principalement de l’hélium 4) ne sont pas radioactifs, mais lorsque la réaction utilisée émet des neutrons rapides, ces derniers peuvent transformer les noyaux qui les capturent en isotopes pouvant l’être.
Au sein du Soleil par exemple, la fusion de l’hydrogène, qui aboutit, par étapes, à produire de l’hélium s’effectue à des températures de l’ordre de 15 millions de kelvins, mais suivant des schémas de réaction différents de ceux étudiés pour la production d’énergie de fusion sur Terre.
Pour que la fusion soit énergétiquement rentable, il est nécessaire que l’énergie produite soit supérieure à l’énergie consommée pour l’entretien des réactions et par pertes thermiques vers le milieu extérieur. Dans les réacteurs à fusion, il faut ainsi éviter tout contact entre le milieu de réaction et les matériaux de l’environnement, ce que l’on réalise par un confinement immatériel.
Dans les cas où aucun état à peu près stable n’existe, il peut être impossible de provoquer la fusion de deux noyaux (exemple : 4He + 4He).
Les réactions de fusion qui dégagent le plus d’énergie sont celles qui impliquent les noyaux les plus légers. Ainsi les noyaux de deutérium (un proton et un neutron) et de tritium (un proton et deux neutrons) sont impliqués dans les réactions suivantes :
- deutérium + deutérium → (hélium 3 + 0,82 MeV) + (neutron + 2,45 MeV)
- deutérium + deutérium → (tritium + 1,01 MeV) + (proton + 3,03 MeV)
- deutérium + tritium → (hélium 4 + 3,52 MeV) + (neutron + 14,06 MeV)
- deutérium + hélium 3 → (hélium 4 + 3,67 MeV) + (proton + 14,67 MeV)
Le deutérium (symbole 2H ou D) est un isotope naturel de l'hydrogène. Son noyau atomique possède un proton et un neutron, d'où un nombre de masse égal à 2
Un hydrocarbure (HC) est un composé organique contenant exclusivement des atomes de carbone (C) et d'hydrogène (H). Ils possèdent en conséquence une formule brute de type : CnHm, où n et m sont deux entiers naturels.
Le carbone possède deux isotopes stables dans la nature, 12C (98,89 %) et 13C (1,11 %). Le premier, 12C, a été choisi comme nucléide de référence unique pour la masse atomique 12, après plusieurs propositions (anciennement l’hydrogène, puis conjointement avec l’oxygène pour les chimistes). La masse atomique du carbone reste cependant légèrement supérieure à 12 à cause de la prévalence de ses autres isotopes.
Le radioisotope 14C a une période de 5 730 ans et est couramment utilisé pour la datation d'objets archéologiques jusqu'à 50 000
ans. Il ne sera d'aucune utilité pour les archéologues de demain intéressés par les trésors de la civilisation actuelle
car les explosions thermonucléaires réalisées dans l'atmosphère à partir des années 1960 ont créé des excès considérables.
Composés courants du carbone
Petites molécule et ions
La forme la plus connue du carbone est le dioxyde de carbone CO2, qui est l'un des composants minoritaires de l'atmosphère terrestre (arrivant en quatrième position avec environ 0,03 % mais loin derrière l'azote 78,11 %, l'oxygène 20,953 % et l'argon 0,934 %) produit et métabolisé par les êtres vivants, l'industrie, les voitures et les centrales thermiques.
Sa concentration a augmenté de près de 40% depuis le début de l'ère industrielle. Il possède deux modes de vibration qui absorbent la lumière infrarouge, ce qui en fait un gaz à effet de serre.
Chimie organique
La chimie du carbone est essentiellement covalente.
Le carbone est à la base d'une multitude de composés pouvant contenir un grand nombre d'atomes, en association avec l'hydrogène, l'oxygène, l'azote, les halogènes, le phosphore, le soufre, et les métaux, par liaisons simples, doubles ou triples. L'étude et la synthèse de ces composés constitue la chimie organique.
Hydrocarbures
On appelle « hydrocarbures » les molécules associant carbone et hydrogène. On classe les hydrocarbures en trois familles :
- les alcanes, où le carbone forme des liaisons sp3 (« simples ») : méthane CH4, éthane C2H6, etc. ;
- les alcènes, où au moins un carbone forme des liaisons (« double ») (carbones sp2) : éthène (éthylène) C2H4, propène C3H6, etc. ;
- les alcynes, où au moins un carbone forme des liaisons (« triple ») (carbones sp) : éthyne (acétylène) C2H2, propyne C3H4, etc.
Le kérosène est un mélange d'hydrocarbures contenant des alcanes (CnH2n+2) de formule chimique allant de C10H22 à
C14H30.
http://fr.wikipedia.org/wiki/Alcane
Les alcanes sont des hydrocarbures saturés.
C’est-à-dire qu'ils ne sont constitués que d'atomes de carbone (C) et d'hydrogène (H), liés entre eux par des liaisons simples, ce qui donne un nombre maximal d'atomes d'hydrogène (d'où le nom de "saturé").
Réactions chimiques des alcanes
Les alcanes existent en grande quantité sous forme de gisements naturels de gaz ou de pétrole. L'origine de ces gisements est attribuée à la fermentation de la cellulose des végétaux des temps préhistoriques.
Le gaz naturel est essentiellement constitué de méthane et les pétroles contiennent un mélange d'hydrocarbures (dont des alcanes allant de CH4 à C40H82).
Le méthane, l'éthane, le propane et le butane sont des gaz à température ambiante.
La réaction de combustion des alcanes n'a pas un grand intérêt au niveau chimique car la molécule est complètement détruite. Par contre cette combustion a un grand intérêt pratique puisque les alcanes peuvent être utilisés comme carburant ou combustible du fait que cette réaction est très exothermique (elle libère de la chaleur).
http://www.planetoscope.com/transport/109-Nombre-de-vols-d-avions-dans-le-monde-.html
Les vols d'avions dans le monde
Presqu'un avion décolle toutes les secondes soit 29,2 millions de vols par an.... ou 80 000 environ vols commericaux chaque jour ... on ne connait pas le nombre de vols d'avions militaires
Nombre de vols commerciaux en Europe
En Europe se déroulent chaque jour 28 000 des 80 000 vols mondiaux. En avril 2010, le vendredi 16, quand la moitié de ces 28000 vols étaient cloués au sol du fait du nuage de cendres volcaniques, la perte économique a représenté 200 millions de dollars pour les compagnies aériennes
Au niveau mondial, les émissions du transport aérien ont augmenté de 30% entre 1990 et 2004, alors que le trafic progressait de 94%. L'efficacité énergétique du transport aérien s'est ainsi améliorée de 33% en 14 ans.
On estime qu'il y aura 200 millions de vols par an en 2020.
Mais, selon des études réalisées par le Deutsche Zentrum für Luft und Raumfahr,les émissions de CO2 des avions devraient croître de 3,9% par an jusqu'en 2015.
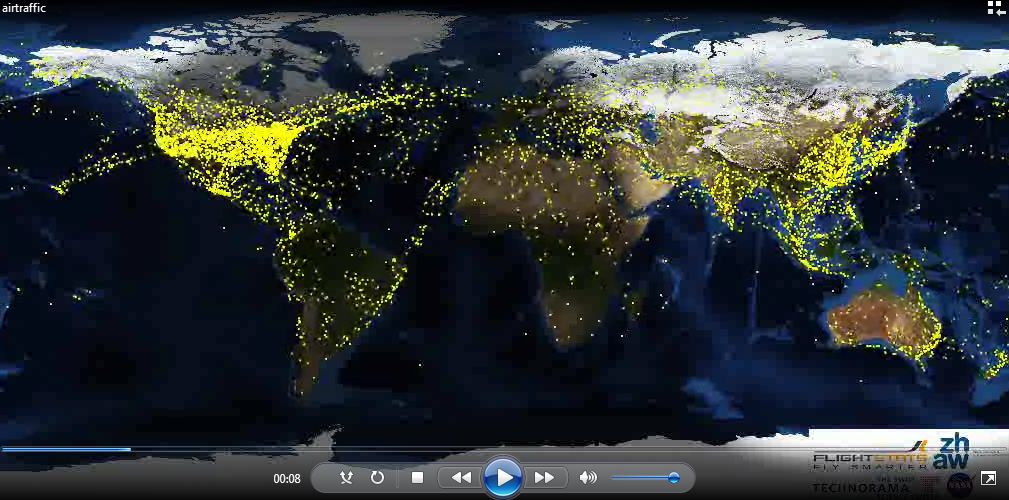
Visualiser le trafic aérien sur 24 heures
Regardez cette vidéo sur laquelle on peut visualiser la densité du trafic aérien qui évolue avec la zone jour / nuit tout autour de la planète. Impressionnant !
Combien de personnes et d'avions dans le ciel à un instant T ?
Sachant qu'on estime qu'il y a 20 000 avions de ligne en état de voler dans le monde, et que chaque avion fait environ 4 vols par jour, soit 5000 avions dans le ciel à tout moment, on peut estimer le nombre de personnes qui sont dans un avion à un moment donné.
Si on prend une moyenne de 100 voyageurs par avion, on a 500 000 personnes dans le ciel à tout instant !
Statistiques mondiales
temps réel
sur les Transports
4.626.841 t.
Le secteur des Transport est responsable d'environ 20% des émissions,soit plus de 4.63 milliards de tonnes de CO₂par an. UNFCCC, 2009
70
Chaque jour pour chaque Européen, ce sont 70 kg de marchandises qui sont mises sur la route, soit 2,5 tonnes par an.
16
EcoConduite 16 conseils pour dépenser moins en conduisant : conseils pour alléger la facture.
Commentaires personnels : La Mondialisation c'est important aujourd'hui, nous partageons tout, y compris la pollution mondialisée. Nous allons tous en profités, nous n'allons pas restés tout seul dans notre coin. A ce prix-là, avec les moyens d'aujourd'hui que nous avons. Nous ne sommes pas archaïques, en effet, depuis 1950, nous pouvons être fiers de nous, nous avons fait le nécessaire relativement vite.
Mais nous partageons, tout, y compris l'irresponsabilité au niveau mondial.