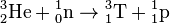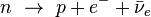Glace carbonique ??
Commentaires personnels : Je pense qu'il est urgent de trouver un élément qui empêche l'hydrogène sous forme de tritium de devenir de l'hélium, car l'hélium et l'hydrogène provoque des réactions de réchauffement. Il faut trouver un élément neutre à envoyer massivement dans l'océan pour neutraliser les réactions chimiques du tritium et l'empêcher de réchauffer les mers. Qui par après est redistribué sur tout l'écosystème et le vivant.
Mais, il faut mettre au point l'élément qui neutralisera le tritium, car chaque année nous déversons du tritium, eau tritiée et le reste, et chaque année il se forme de l'hélium qui est dans l'hydrogène dans les océans, et cela chaque année tous les 13 ans après l'avoir jeté, le tritium se tronsforme en hélium et il est au contact de l'hydrogène qui se trouve naturellement dans les mers. J'ai mis pêle-mêle quelques éléments qui soulèvent ma curiosité, mais je ne suis pas chimiste. Grande responsabilité !
Et le dioxyde de carbonne sous forme de calotte glaciaire ne laisse aucun résidu. Et permettrait peut être de limiter la fonte des glaciers, Car il est réfrigérant.
http://fr.wikipedia.org/wiki/Dioxyde_de_carbone
Sous forme solide

Le dioxyde de carbone sous forme solide a de nombreuses appellations : « glace carbonique », « neige carbonique », « carboglace », « glace sèche ». Il est issu de la solidification du CO2 liquide. On obtient de la neige carbonique qui est ensuite comprimée pour obtenir de la glace carbonique.
Cette glace carbonique se sublime en ne laissant aucun résidu et consomme une grande quantité de chaleur (150 kcal/kg, soit 628 kJ/kg, à -78,5 °C)[réf. nécessaire] et à 1 atm. On lui a donc rapidement trouvé de
multiples utilisations en tant que réfrigérant.
Il est commercialisé sous différentes présentations selon son usage :
- en granules (de la taille d'un grain de riz de 3 mm de diamètre) : essentiellement pour le nettoyage et le décapage cryogénique ;
- en bâtonnets (d'une longueur d'environ 16 mm) : pour la conservation, le transport des produits sous température dirigée (produits pharmaceutiques, transport de surgelés, transport d'échantillons, etc.) ;
- pour la recherche fondamentale ou appliquée ;
- pour la vinification : il ralentit la fermentation et évite l'oxydation ;
- en plaquette ou en blocs :
- pour le ravitaillement aérien (catering), les traiteurs, les pompes funèbres, etc.
- en pains :
- pour faire de la fumée épaisse (effets spéciaux, cinéma, vidéo).
Le dioxyde de carbone sous forme solide est également présent en abondance aux pôles de la planète Mars, où il forme de véritables calottes glaciaires.
Son étymologie provient du grec Hélios (Ἥλιος / Hếlios), le Soleil, ce gaz ayant été observé pour la première fois dans le spectre solaire.
L'hélium est, après l'hydrogène, l'élément le plus abondant de l'Univers. Actuellement, pratiquement tout l'hélium a été produit lors de la nucléosynthèse primordiale. Les autres origines sont discutées ci-après dans la sous-section abondance naturelle.
L’hélium 3, noté 3He, est l'isotope de l'hélium dont le nombre de masse est égal à 3. Il est présent dans les couches externes du Soleil[
L’hélium 3 pur est le liquide au point d’ébullition le plus bas qui existe, environ 3,2 K à pression atmosphérique.
On a longtemps cherché un état superfluide, que l’hélium 4 possède au point lambda à 2,1768 K. 3He devient superfluide en dessous de 2,65 mK ; il y aurait un deuxième type de superfluidité en dessous de 1,8 mK
Les deux isotopes de l’hélium permettent aussi des frigos à dilution, car la dilution de 3He dans 4He (liquides) produit du froid.
Propriétés nucléaires
L'hélium 3 a la particularité d'être un fort absorbant de neutrons.
La réaction d'absorption d'un neutron est la suivante :
L'absorption d'un neutron par un noyau d'hélium 3 se traduit donc par la formation de tritium radioactif.
Le tritium (T ou 3H) est - comme le deutérium - l'un des isotopes de l'hydrogène. Il possède 1 proton et 2 neutrons. Il a été mis en évidence en 1934, par Ernest Rutherford, dans la réaction nucléaire D+D→T+H.
À la différence du deutérium et de l'hydrogène 1, ce nucléide est radioactif. Il émet un rayonnement bêta (β-) (de faible énergie) en se transformant en hélium 3 (3He).
Sa période ou demi-vie est de 12,32 ans.
La légère différence massique d'une même molécule selon qu'elle contienne des atomes d'hydrogène ou de tritium explique des différences de comportements, en particulier concernant l'eau tritiée lors des processus naturels de changement de phase (évaporation, condensation, cristallisation, etc.) source d'un faible enrichissement en tritium de la phase condensée par rapport à l’hydrogène (plus léger).
Comme l'hydrogène, le tritium gazeux est difficile à stocker à température ambiante.
Propriétés chimiques
En s'oxydant en présence d'oxygène, même en milieu sec il produit de l'eau tritiée (HTO ou T2O), s'il y a une source de chaleur ou une étincelle.
La demi-vie du tritium est de 12,32 ans[1].
Il se transforme en hélium 3 par la réaction :
La radioactivité bêta ou émission bêta (symbole β) est, à l'origine, un type de désintégration radioactive dans laquelle une particule bêta (un électron ou un positron) est émise. On parle de désintégration bêta moins (β-) ou bêta plus (β+) selon que c'est un électron (particule chargée négativement) ou un positron (particule chargée positivement) qui est émis. Aujourd'hui, la désintégration β se généralise à toutes les réactions nucléaires impliquant les neutrinos ou anti-neutrinos se résumant par la relation suivante :

Dans cette dernière relation un électron ou un neutrino se transforme en son antiparticule par le passage de part et d'autre de la double flèche. Toutes ces réactions sont régies par la force nucléaire faible et sont possibles si le bilan énergétique le permet.
Désintégration β-
Un neutron est converti en proton par l'intermédiaire de la force nucléaire faible et une particule β- (un électron) et un anti-neutrino sont émis :
En fait, le neutron n'est pas une particule élémentaire mais est composé d'un quark up et de deux quarks down (udd). C'est un de ses quarks down qui interagit dans la radioactivité β, en se transformant en quark up, formant alors un proton (uud). Au niveau le plus fondamental, l'interaction faible change la saveur d'un simple quark :
qui est suivi immédiatement par la désintégration du W − :
Le spectre d’énergie (nombre de particules émises en fonction de leur énergie cinétique) des β- (électrons) est continu en raison du partage de l'énergie entre les trois corps. Il n'y a pas d'énergie minimale.
La réaction est énergétiquement possible à la seule condition que le noyau atomique fils soit moins lourd que le noyau père.
Exemple d'une réaction β- pour le tritium (3H+) qui se transforme en hélium 3 (3He2+) :

L'isotope le plus abondant, l'hélium 4, est produit sur Terre par la radioactivité α d'éléments lourds : les particules α qui y sont produites sont des noyaux d'hélium 4 complètement ionisés. L'hélium 4 est un noyau à la stabilité inhabituelle, parce que ses nucléons sont arrangés en couches complètes.
L'hélium 3 n'est présent sur Terre qu'à l'état de traces ; la plupart date de la formation de la Terre, bien qu'un peu tombe encore dessus, piégé dans la poussière interstellaire[12]. Des traces sont aussi produites encore par la radioactivité β du tritium[13].
Fonctionnement technique
La cryogénie alimentaire utilise 2 isotopes (atome d'un élément chimique dont le noyau a le même nombre atomique Z), l'hélium 3 (rare) et l'hélium 4 (commun).
Lorsque la température s'approche du zéro absolu, la mixture subit spontanément une phase de séparation vers une forme riche en hélium 3 et une forme pauvre en hélium 3 (?).
Généralement, les réfrigérateurs cryogéniques (à dilution d'hélium) fonctionnent dans un cycle continu. L'hélium 3 est liquéfié dans un condenseur qui est relié à la zone riche en d'hélium 3. Les atomes d'3He migrent à travers la zone pauvre en 3He (riche en 4He), fournissant la puissance de refroidissement, puis arrivent dans un distillateur où ils s'évaporent pour recommencer un cycle.
Le dioxyde de carbone est naturellement présent dans l'atmosphère terrestre à une concentration de près de 0,039 % en volume au début des années 2010[12], c'est-à-dire 390 ppmv (parties par million en volume) ou 591 ppmm (parties par million en masse). En 2009, cette concentration atteignait précisément 386 ppmv[13], contre seulement 283,4 ppmv en 1839 d'après les carottes de glace prélevées dans la région du cap Poinsett dans l'Antarctique[14], soit une augmentation globale de 36,2 % en 170 ans[15].
Le CO2 est un gaz à effet de serre bien connu, transparent en lumière visible mais absorbant dans le domaine infrarouge, de sorte qu'il tend à bloquer la réémission vers l'espace de l'énergie thermique reçue au sol sous l'effet du rayonnement solaire ; il serait responsable de 26 % de l'effet de serre à l'œuvre dans notre atmosphère (la vapeur d'eau en assurant 60 %)[16], où l'augmentation de sa concentration serait en partie responsable du réchauffement climatique constaté à l'échelle de notre planète depuis les dernières décennies du XXe siècle.
Utilisation industrielle
L’industrie a fait de nombreux usages de la vapeur d’eau ; principalement comme fluide caloporteur ou pour le fonctionnement de machines à vapeur (voir en particulier la locomotive à vapeur). Accessoirement, sa détente est utilisée dans des éjecteurs à vapeur servant à pomper des fluides (pour faire le vide, par exemple), ou dans des sirènes ou sifflets. On utilise aussi ses propriétés de transfert de chaleur pour les procédés de stérilisation.
La vapeur est produite dans des chaudières chauffées par un combustible fossile, parfois électriques, ou bien plus généralement par ébullition de l’eau mise au contact d’une source chaude, comme dans les générateurs de vapeur de certaines centrales nucléaires, dans les réacteurs nucléaires à eau bouillante, ou dans le sous-sol afin d’exploiter l’énergie géothermique.
Gaz à effet de serre
Présente en grande quantité dans l'atmosphère, la vapeur d'eau est le principal gaz à effet de serre.
http://fr.wikipedia.org/wiki/Aquariophilie
Maintenance des plantes
Les plantes ont besoin d'eau, de lumière, de CO2 et d'engrais pour se développer. L'eau est forcément omniprésente dans un aquarium et la lumière est apportée par l'éclairage. L'eau, l'éclairage et les déchets produits par les poissons suffisent à faire pousser les plantes, qui n'ont pas besoin d'autre nourriture. Du dioxyde de carbone ou de l'engrais peuvent être introduits dans un bac pour favoriser le développement des plantes.
La maintenance se limite à des activités occasionnelles telle que tailler les plantes et éliminer les feuilles mortes pour éviter une modification de la composition de l'eau.
Les tiges des plantes aquatiques sont molles, et contiennent des petites bulles d'oxygène qui leur donne un poids équivalent à celui de l'eau. Les plantes aquatiques ont peu de racines et puisent leur nourriture dans l'eau à travers les feuilles. Les plantes se nourrissent de minéraux dissous comme le phosphore ou le potassium, de nitrates et du gaz CO2 dissous dans l'eau et ont besoin de lumière pour la photosynthèse.
Les plantes aquatiques peuvent être plantées sur un sol pauvre, fait de sable ou de gravier. L'utilisation d'un support de culture fait de tourbe et de sable placé au fond de l'aquarium accélère la croissance des plantes.
Les plantes tendres peuvent servir de nourriture pour les poissons.
Utilisation du CO2
Autrefois, il était courant de placer un diffuseur d'air dans son aquarium pour apporter l'oxygène nécessaire à la respiration des poissons. Cela était nécessaire car les aquariums étaient peu voire pas plantés. Depuis la fin des années 1990, on a pu observer une nette amélioration des systèmes d'éclairages (spectres adaptés aux besoins des plantes), ce qui permet d'élargir la palette des plantes qu'il est possible de maintenir en aquarium si bien qu'aujourd'hui, l'aquarium planté devient courant et il n'est plus nécessaire d'apporter de l'oxygène par l'intermédiaire d'un diffuseur d'air. La tendance actuelle est d'injecter du CO2 dans l'aquarium pour satisfaire les plantes qui vont produire l'oxygène nécessaire. Différents modes de diffusion de CO2 existent :
- bouteille sous pression munie d'un détendeur (c'est le système qui permet la diffusion la plus régulière),
- production artisanale par fermentation des levures.
Le CO2 permet d'obtenir des plantes en meilleure santé, mais également de réduire significativement les algues (en favorisant la pousse des plantes, on fait régresser les algues).
Engrais
En aquariophilie, l'apport d'engrais se réduit aux éléments secondaires comme le calcium (Ca), le soufre (S) et le magnésium (Mg) ainsi que des oligo-éléments tels que le fer (Fe), le manganèse (Mn), le molybdène (Mo), le cuivre (Cu), etc., le fer étant l'élément le plus important pour la croissance des plantes.
Les éléments principaux, Azote (N), Phosphore (P) et Potassium (K) ne sont jamais introduits dans un bac d'eau douce car ils sont le résultat des déchets produits par les animaux et les plantes. Le cycle de l'azote apporte les éléments principaux. En rajouter ne ferait que polluer d'autant plus le bac.
Élevage et sauvegarde des espèces aquatiques
Les poissons étant des animaux très inféodés à leur milieu, tout aquarium devra tenter de fournir à ses habitants un biotope adapté à leurs besoins (nature de l'eau, température, espace disponible, paramètres de l'eau (pH, TH, NO2…), etc.) pour favoriser leur reproduction.
http://aqua-paca.naturalforum.net/t58-le-co2
Le CO2, une invention de la nature
Le co2 ou gaz carbonique est vital pour toutes les plantes. A partir du CO2, de la lumière et de l'eau, les plantes vont fabriquer leur principale source d'énergie: LE SUCRE.
Elles rejettent ensuite de l'oxygène, dont tous les animaux ont besoin pour respirer. Ce processus appelé photosynthèse est la base de toute la vie sur terre.
Les plantes de nos aquariums ont besoins aussi de co2
Les plantes aquatiques absorbent le co2 dissous dans l'eau. Dans les cours d'eau naturels, le co2 est fourni en permanence par la couche de boue souvent épaisse du sol et produit en grande quantité par des processus de décomposition bactérienne. Les plantes vigoureuses que l'on trouve dans la nature en témoignent. Une végétation luxuriante favorise également la bonne croissance des poissons.
Pourquoi le co2 dans l'aquarium
La plupart du temps, l'eau de l'aquarium est trop pauvre en co2. Les centrales hydrauliques retirent deja le co2 naturel de l'eau de conduite par un processus d'aération. Les faibles quantités de co2 présentes dans l'aquarium sont alors absorbées avidement par les plantes aquatiques. Mais la plupart du temps, cela ne suffit pas. Tiges et feuilles perdent de leur vigueur et de leur éclat, et les plantes ne poussent pas. Les systèmes immunitaires sont affaiblis, et des formations d'algues apparaissent peu à peu sur les feuilles.
Contrairement à ce qui se passe dans la nature, l'approvisionnement naturel en co2 est impossible dans un aquarium.
Avantages du co2
- Le co2 se dissout dans l'eau en partie sous forme de dioxyde de carbone. Avec le co2, il est donc possible de régler la teneur en PH de l'eau de l'aquarium en définissant des valeurs proches de celles d la nature et qui seront bénéfiques aux plantes et aux poissons dont le ph diffère selon le biotope choisi.
-Il permet une meilleure production d'oligo-éléments nécessaires pour les plantes et les poissons.
-Limite les dépots calcaires sur les feuilles des plantes (décalcification biogène).
Afin de connaitre la quantité injecté dans l'aquarium et pour savoir si on est pas en sur-injection ou en sous-injection on utilise un tableau de relation ph/kh. En fonction de vos valeurs de ph et de kh vous pouvez déterminer si votre alimentation en co2 est optimale ou non:
Conclusion
Vous aurez compris de par cet article de l'intéret de posséder une injection de co2 doublement bénéfique, et pour les plantes et pour abaisser son ph afin d'y maintenir certains poissons.