http://fr.wikipedia.org/wiki/Hydrog%C3%A8ne
hydrogène est un élément chimique de symbole H et de numéro atomique 1.
L'hydrogène est le principal constituant du Soleil et de la plupart des étoiles, dont l'énergie provient de réactions de fusion thermonucléaire de l'hydrogène.
Le nom hydrogène est composé du préfixe « hydro », du grec ὕδωρ (hudôr) signifiant « eau », et du suffixe « gène », du grec γεννᾰν (gennen), « engendrer ». Ce nom a été inventé par Lavoisier pour désigner le gaz appelé à l'époque « air inflammable » et qui avait été mis en évidence par Cavendish en 1766 Il s'agit du gaz de formule chimique H2 dont le nom scientifique est désormais dihydrogène.
Dans le langage courant, le dihydrogène est appelé encore très fréquemment « hydrogène ». Pour les propriétés relatives à ce gaz (propriétés chimiques, production industrielle, stockage, dangers…), se référer à l'article dihydrogène.
L'atome d'hydrogène
L'hydrogène est l'élément chimique le plus simple ; son isotope le plus commun est constitué seulement d'un proton et d'un électron. L'hydrogène est ainsi le plus léger atome existant. Comme il ne possède qu'un électron, il ne peut former qu'une liaison covalente : c'est un atome univalent.
Cependant, l'hydrogène solide peut être métallique lorsqu'il se trouve sous très haute pression. Il cristallise alors avec une liaison métallique (voir hydrogène métallique). Dans le tableau périodique des éléments, il se trouve dans la colonne des métaux alcalins. N'étant pas présent dans cet état sur Terre, il n'est toutefois pas considéré comme un métal en chimie.
L'hydrogène est l'élément le plus abondant de l'Univers : 75 % en masse et 92 % en nombre d'atomes. Il est présent en grande quantité dans les étoiles et les planètes gazeuses ; il est également le composant principal des nébuleuses et du gaz interstellaire.
Dans la croûte terrestre, l'hydrogène ne représente que 0,22 % des atomes, loin derrière l'oxygène (47 %) et le silicium (27 %)[5]. Il est rare également dans l'atmosphère terrestre, puisque le dihydrogène ne représente en volume que 0,55 ppm des gaz atmosphériques. Sur Terre, la source la plus commune d'hydrogène est l'eau, dont la molécule est constituée de deux atomes d'hydrogène et d'un atome d'oxygène ; l'hydrogène est surtout le principal constituant (en nombre d'atomes) de toute matière vivante, associé au carbone dans tous les composés organiques. Par exemple, l'hydrogène représente 63 % des atomes du corps humain[5].
Sous de très faibles pressions, comme celles qui existent dans l'espace, l'hydrogène a tendance à exister sous forme d'atomes individuels, simplement parce qu'il est alors improbable qu'ils entrent en collision pour se combiner. Les nuages de dihydrogène sont à la base du processus de la formation des étoiles.
L'hydrogène présent en grandes quantités dans le cœur des étoiles est une source d'énergie via les réactions de fusion nucléaire, qui combinent 4 noyaux d'atomes d'hydrogène (4 protons) pour former un noyau d'atome d'hélium. Les deux voies de cette fusion nucléaire naturelle sont la chaîne proton-proton, de Eddington, et le cycle carbone-azote-oxygène catalytique, de Bethe et von Weizsäcker.
La fusion nucléaire réalisée dans les bombes à hydrogène ou bombes H concerne des isotopes intermédiaires de la fusion (de l'hydrogène en hélium) en cours dans les étoiles : isotopes lourds de l'hydrogène, hélium 3, tritium...
En effet, dans une bombe H, les réactions nucléaires ne durent que quelques dizaines de nanosecondes, ce qui permet uniquement des réactions en une unique étape. Or, la transformation de l'hydrogène en hélium s'effectue en plusieurs étapes, dont la première (la réaction d'un proton) est extrêmement lente.
La fusion nucléaire, dite parfois fusion thermonucléaire, est un processus où deux noyaux atomiques s’assemblent pour former un noyau plus lourd. Cette réaction est à l’œuvre de manière naturelle dans le Soleil et la plupart des étoiles de l'univers.
La fusion de noyaux légers dégage d’énormes quantités d’énergie provenant de l’attraction entre les nucléons due à l’interaction forte (voir Énergie de liaison atomique). Elle est, avec la fission, l’un des deux principaux types de réactions nucléaires appliquées. Un de ses intérêts est de pouvoir produire théoriquement beaucoup plus d’énergie (de 3 à 4 fois plus), à masse de « combustible » égale, que la fission. De plus, les océans contiennent naturellement suffisamment de deutérium, 16 grammes par m3, pour permettre d’alimenter en énergie la planète pendant quelques centaines de millénaires[réf. nécessaire] (1 m3 d'eau peut potentiellement fournir autant d'énergie que la combustion de 670 tonnes de pétrole)[réf. nécessaire]. En dépit des travaux de recherche réalisés dans le monde entier depuis les années 1950, aucune application industrielle de la fusion à la production d’énergie n’a encore abouti, en dehors du domaine militaire avec la bombe H, étant donné que cette application ne vise aucunement à contenir et maîtriser la réaction produite. Il en existe cependant quelques autres usages moins médiatisés, comme les générateurs de neutrons[1].
Contrairement à la fission nucléaire, les produits de la fusion eux-mêmes (principalement de l’hélium 4) ne sont pas radioactifs, mais lorsque la réaction utilisée émet des neutrons rapides, ces derniers peuvent transformer les noyaux qui les capturent en isotopes pouvant l’être.
Il ne faut pas confondre la fusion nucléaire avec la fusion du cœur d’un réacteur nucléaire, qui est un accident nucléaire particulièrement redoutable[2].
La fusion nucléaire, dite parfois fusion thermonucléaire, est un processus où deux noyaux atomiques s’assemblent pour former un noyau plus lourd.
Une réaction
de fusion nucléaire nécessite que deux noyaux atomiques s’interpénètrent. Il faut pour cela que les noyaux surmontent la répulsion due à leurs charges électriques toutes deux positives (phénomène dit de « barrière coulombienne »). Si l’on appliquait uniquement les lois de la mécanique classique, la probabilité d’obtenir la fusion des noyaux serait très faible, en raison de l’énergie cinétique (correspondant à l’agitation thermique) extrêmement élevée nécessaire au franchissement de la barrière. Cependant, la mécanique quantique prévoit, ce qui se vérifie en pratique, que la barrière coulombienne peut également être franchie par effet tunnel, à des énergies plus faibles.
Les énergies nécessaires à la fusion restent très élevées, correspondant à des températures de plusieurs dizaines ou même centaines de millions de degrés selon la nature des noyaux (voir plus bas : Plasmas de fusion). Au sein du Soleil par exemple, la fusion de l’hydrogène, qui aboutit, par étapes, à produire de l’hélium s’effectue à des températures de l’ordre de 15 millions de kelvins, mais suivant des schémas de réaction différents de ceux étudiés pour la production d’énergie de fusion sur Terre. Dans certaines étoiles plus massives, des températures plus élevées permettent la fusion de noyaux plus lourds.
Lorsque de petits noyaux fusionnent, le noyau résultant se retrouve dans un état instable et doit revenir à un état stable d’énergie plus faible, en éjectant une ou plusieurs particules (photon, neutron, proton, noyau d’hélium, selon le type de réaction), l’énergie excédentaire se répartit entre le noyau et les particules émises, sous forme d’énergie cinétique. Pour que la fusion soit énergétiquement rentable, il est nécessaire que l’énergie produite soit supérieure à l’énergie consommée pour l’entretien des réactions et par pertes thermiques vers le milieu extérieur. Dans les réacteurs à fusion, il faut ainsi éviter tout contact entre le milieu de réaction et les matériaux de l’environnement, ce que l’on réalise par un confinement immatériel.
Dans les cas où aucun état à peu près stable n’existe, il peut être impossible de provoquer la fusion de deux noyaux (exemple : 4He + 4He).
Les réactions de fusion qui dégagent le plus d’énergie sont celles qui impliquent les noyaux les plus légers. Ainsi les noyaux de deutérium (un proton et un neutron) et de tritium (un proton et deux neutrons) sont impliqués dans les réactions suivantes :
Si la fission est contrôlée depuis longtemps pour la production d'électricité, ce n'est pas le cas de la fusion.
Cette réaction est difficile à réaliser car il faut rapprocher deux noyaux qui ont tendance naturellement à se repousser. Maîtriser sur Terre la fusion de noyaux légers, tels que le deutérium et le tritium, ouvrirait la voie à des ressources en énergie quasiment illimitées. Cet enjeu considérable a mené les communautés scientifiques nationales et internationales à lancer plusieurs projets d'envergure. Une centrale électrique à fusion produirait beaucoup plus d'énergie qu'une centrale à fission.
http://fr.wikipedia.org/wiki/Tritium
Le tritium (T ou 3H) est - comme le deutérium - l'un des isotopes de l'hydrogène. Il possède 1 proton et 2 neutrons. Il a été mis en évidence en 1934, par Ernest Rutherford, dans la réaction nucléaire D+D→T+p.
À la différence du deutérium, cet élément est radioactif. Il émet un rayonnement bêta (β-) (de faible énergie) en se transformant en hélium 3 (3He).
Sa période ou demi-vie est de 12,32 ans.
Son activité spécifique (ou activité massique) est de 3,59×1014 Bq/g (soit 359 TBq/g ou 359 PBq/kg) ou 9703 curies par gramme (soit 9,7 MCi/kg).
Propriétés physiques
Le tritium a une masse atomique de 3,0160492. Il est gazeux (HT ou T2) dans les conditions normales de température et de pression.
La légère différence massique d'une même molécule selon qu'elle contienne des atomes d'hydrogène ou de tritium explique des différences de comportements, en particulier concernant l'eau tritiée lors des processus naturels de changement de phase (évaporation, condensation, cristallisation, etc.) source d'un faible enrichissement en tritium de la phase condensée par rapport à l’hydrogène (plus léger).
Comme l'hydrogène, le tritium gazeux est difficile à stocker à température ambiante.
En s'oxydant en présence d'oxygène, même en milieu sec il produit de l'eau tritiée (HTO ou T2O), s'il y a une source de chaleur ou une étincelle. (Oxydation, tout comme l'isotope léger H2) ; environ 1 % du tritium est converti en 1 heure, et d'autant plus vite que le milieu sera humide.[réf. souhaitée]
La demi-vie du tritium est de 12,32 ans[1].
Il se transforme en hélium 3 par la réaction :
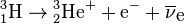 .
.La réaction dégage une énergie maximale (Emax) de 18,6 keV et moyenne (Emoy) de 5,7 keV ; l'électron emportant en moyenne une énergie cinétique de 5,7 keV, le reste étant emporté par un antineutrino électronique (pratiquement indétectable). Son énergie particulièrement faible le rend difficile à détecter autrement que par scintigraphie.
La radioactivité β de faible énergie fait que les électrons émis sont rapidement arrêtés dans l'eau et dans les tissus biologiques, après avoir parcouru seulement 6 μm tout au plus (et en moyenne environ 0,56 μm)[2]. Un rayonnement externe est donc rapidement arrêté par la simple surface « morte » de la peau humaine.
Cependant, contrairement à leur rayonnement, la plupart des molécules tritiées (HTO ou OBT) sont facilement absorbées à travers la peau, des membranes ou tissus biologiques de tous les êtres vivants. Sa radioactivité ne le rend donc potentiellement dangereux que s'il est inhalé ou ingéré, et a priori uniquement dans les cellules vivantes qu'il aura pénétré.
Production
Le tritium est naturellement issu de l'interaction entre le rayonnement cosmique et l'atmosphère. La réaction dominante est l'interaction entre un neutron rapide (de plus de 4 MeV) et un atome d'azote[3], par réaction (n,T) :
 .
.Le tritium peut être abondamment produit par l'homme en bombardant du lithium par un flux neutronique. C'est le cas dans le réacteur d'une centrale nucléaire. L'isotope léger (6Li), présent dans le lithium naturel à raison de 7,5 %, capture les neutrons et donne des noyaux d'hélium et de tritium suivant la réaction :
En milieu nucléaire, l'hélium 3 produit par la désintégration du tritium est lui-même réactivé en tritium par capture neutronique, facilité par sa grande section de capture :
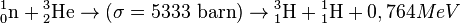 Production industrielle[modifier]
Production industrielle[modifier]

La principale source civile de tritium dans le monde sont les réacteur CANDU, modérés à l'eau lourde, où il constitue un produit d'activation. Dans certains réacteurs, le tritium est périodiquement extrait du modérateur, et peut être disponible pour une utilisation industrielle.
Le tritium est extrait d'eau lourde au « Tritium Removal Facility » (TRF) en deux étapes : extraction catalytique en phase vapeur, puis distillation cryogénique. Le TRF produit annuellement 2,5 kg de tritium[8].
C'est la source envisagée pour le démarrage d'ITER.
Le tritium à usages militaires est produit en réacteurs d'irradiations, par irradiation de lithium. C'est la méthode choisie par l'autre grand fournisseur de tritium civil, Reviss Services et envisagée pour le fonctionnement continu d'ITER.
La fusion thermonucléaire destinée à produire de l'énergie devrait bientôt utiliser le lithium dans une zone périphérique dite de couverture, enveloppant le cœur du réacteur, pour intercepter un maximum de neutrons produits par les réactions de fusion. Le tritium ainsi produit servirait à remplacer le tritium consommé par la réaction, ce qui limiterait le transport de matières radioactives.
Le tritium anthropique
Il est émis dans l'air, l'eau et les sols par l'Homme depuis les années 1940, à des doses dépassant de loin les taux naturels, via deux sources principales : les installations nucléaires et les explosions nucléaires.
Réacteurs, usines de retraitement et production d'armes avaient de 1950 à 1997 déjà dispersé environ 297 PBq de tritium, auxquels il faut ajouter 2,8 PBq de carbone 14, selon l'évaluation faite par l'UNSCEAR en 2000[21]. Les installations nucléaires en produisaient 0,005 mSv/an selon l’UNSCEAR en 2000. Selon le CEA, de 1995 à 1997, les réacteurs à eau légère en ont rejeté chacun en moyenne 2,4.1012 Bq sous forme gazeuse et 1,9.1013 Bq sous forme d’eau tritiée par an (UNSCEAR 2000). La Hague en France produirait environ 10 x1015 Bq de tritium/an (pour 1 600 t de déchets retraités)[19]).

Le tritium est, avec le carbone 14, l'un des deux radionucléides les plus émis dans l’environnement par les installations nucléaires en fonctionnement normal. Selon l'Autorité de sûreté nucléaire, en France, bien que les « activités » des rejets d'autres radionucléides ont fortement diminué (d’un facteur 100 voire plus) des années 1985 aux années 2005, « les activités en tritium et en carbone 14 restent globalement constantes, voire augmentent pour certaines installations »[22]. Cela étant, « l’impact global de ses rejets, en France, est faible ; la dose efficace annuelle pour les groupes de référence est inférieure au ou de l’ordre du μSv. »[23]
Les réacteurs nucléaires et l'industrie nucléaire produisent du tritium :
Sans valorisation économique envisageable, ce déchet radioactif réputé peu dangereux était en grande partie libéré dans l'air et l'eau. Futur combustible des projets de réacteurs ITER, il pourrait acquérir une valeur économique. Mais on ne connaît pas aujourd'hui de moyen raisonnablement coûteux, de filtrer, isoler ou stocker correctement le tritium. Cet atome étant actif et parmi les plus petits (sous forme gazeuse), il se diffuse par les porosités les plus fines, passant par exemple au travers du caoutchouc et se diffusant dans la plupart des types d'aciers. Il peut s'évaporer, se diluer dans de l'eau et pénétrer le béton s'il n'est pas protégé par une couche spéciale.
Arguant de sa faible radiotoxicité et de sa dilution isotopique aisée dans l'eau, les gros producteurs de tritium ont demandé (et obtenu) des normes leur permettant de disperser et de diluer le tritium dans l'environnement.
L'usine de la Hague a déclaré en 1999, 8.1013 Bq (soit 0,22 g de tritium) et les rejets liquides à 13.1015Bq (soit 36 g). Pour l'année 2002, elle en a rejeté respectivement 11 900 TBq et 63,2 TBq (source Areva NC).
En 1997, les rejets gazeux de tritium de l'usine de Sellafield (GB) ont été de 1,7.1014 Bq et les rejets liquides de 2,6.1015 Bq (BNFL, 1997).
La possibilité d'une bioamplification du tritum a été avancée par certaines ONG (Crii-Rad, Greenpeace, ACRO…) qui dénoncent depuis les années 1980 les larges autorisations de rejets industriels de tritium et de carbone 14, en s'appuyant sur l'idée que des organismes filtreurs (ou biointégrateurs) peuvent métaboliser ou reconcentrer de nombreux toxiques dilués dans l'environnement
Commentaires personnels : Ils ont réussi à réchauffer la terre comme le "soleil", ondes radios, et les différentes ondes, la terre et le soleil sont entourés d'ondes électromagnétiques, et grâce à l'augmentation de l'électromagnétisme et à l'hydrogène et l'hélium, nous avons le réchauffement planétaire, qui menace la terre d'extinction car la terre n'est pas le soleil.